Die Epigenetik ist ein hochaktuelles Gebiet der biomedizinischen Forschung. Sie beschreibt vererbbare Veränderungen in der Expression von Proteinen und damit dem Funktionsstatus von Zellen, die OHNE Veränderung der genetischen Information ablaufen.
Solche Veränderungen können zum einen durch DNA-Methylierung und zum anderen durch Histon-Modifikationen ausgelöst werden. Histone sind basische Proteine, die mit der DNA assoziiert sind.
Den Komplex aus DNA, Histonen und auch anderen Proteinen nennt man Chromatin. Enzymatische Veränderungen an den Histonen,
wie die reversible Acetylierung oder Methylierung der Seitenkette von Lysinresten, haben einen Einfluss auf die Genaktivität.
Sie sind beteiligt an der Pathogenese von Krebs, aber auch anderen Erkrankungen, und bieten daher Ansatzpunkte für eine Pharmakotherapie.
Unser Forschungsschwerpunkt liegt im Bereich der Synthese von Hemmstoffen Histon-modifizierender Enzyme, der Entwicklung von Assaymethoden zur Bestimmung der Hemmpotenz dieser
Inhibitoren sowie der Validierung der In-vitro-Ergebnisse auf zellulärer Ebene. Wir bearbeiten dabei zinkabhängige Histon-Desacetylasen (HDACs),
NAD+-abhängige Histon-Desacetylasen (Sirtuine), Acetyl- bzw. Methyltransferasen und verschiedene Arten von FAD- bzw. Fe(II)-/Ketoglutarat-abhängigen Demethylasen
sowie sogenannte Reader-Proteine wie Spindlin1. Ein Teil der biologischen Arbeiten werden mit verschiedenen Kooperationspartnern durchgeführt.
Besonders wichtig ist dabei der Sonderforschungsbereich Medizinische Epigenetik (www.sfb992.uni-freiburg.de)
<
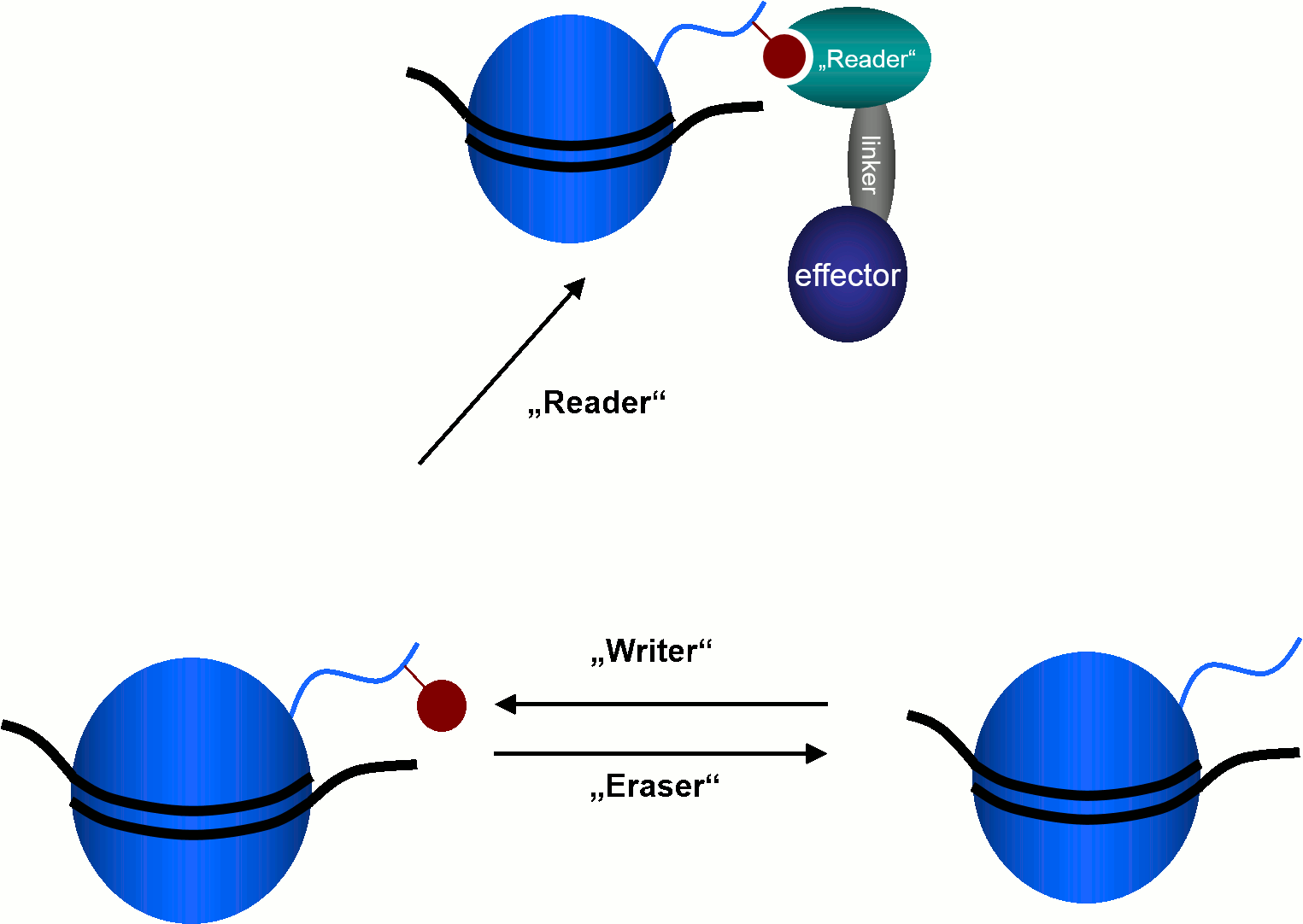
Epigenetische Proteine, die an Histonen wirken, lassen sich grundsätzlich in drei Klassen einteilen. "Reader"-Proteine erkennen bestimmte Histon-Modifikationen und lösen dadurch verschiedene zelluläre Effekte aus."Writer"-Enzyme katalysieren die Anheftung von posttranslationalen Histon-Modifikationen an bestimmte Seitenketten der Histon-Proteine. Dazu zählen beispielsweise Histon-Acetyl-Transferasen (HATs) und Methyltransferasen.
Die Abspaltung dieser posttranslationalen Modifikationen wird durch "Eraser"-Enzyme wie Histon-Desacetylasen (HDACs) und Lysin-Demethylasen katalysiert.
<
Wir bearbeiten die folgenden Targets:
-
Histondesacetylasen
- HDAC1
Isoform-selective HDAC1/6/8 inhibitors with an imidazo-ketopiperazine cap containing stereochemical diversity.
B. Lecointre, R. Narozny, M. T. Borello, J. Senger, A. Chakrabarti, M. Jung, M. Marek, C. Romier, J. Melesina, W. Sippl, L. Bischoff, A. Ganesan;
Phil. Trans. R. Soc. B 373 (2018) 20170364.Link
- HDAC6
Synthesis and Biological Investigation of Oxazole Hydroxamates as Highly Selective Histone Deacetylase 6 (HDAC6) Inhibitors.
J. Senger, J. Melesina, M. Marek, C. Romier, I. Oehme, O. Witt, W. Sippl, M. Jung;
J. Med. Chem. 59 (2016) 1545-1555. Link
- HDAC8
Structure-based design and biological characterization of selective HDAC8 inhibitors with anti-neuroblastoma activity.
T. Heimburg, F. R. Kolbinger, P. Zeyen, E. Ghazy, D. Herp, K. Schmidtkunz, J. Melesina, D. Robaa, F. Erdmann, M. Schmidt, C. Romier, O. Witt, I. Oehme, M. Jung, W. Sippl;
J. Med. Chem. 60 (2017) 10188-10204. Link
- HDAC10
- schistosomale HDACs
Synthesis, crystallization studies and in vitro characterization of novel cinnamic acid derivatives as SmHDAC8 inhibitors for the treatment of Schistosomiasis.
T. Bayer, A. Chakrabarti, J. Lancelot, T. B. Shaik, K. Hausmann, J. Melesina, K. Schmidtkunz, M. Marek, F. Erdmann, M. Schmidt, D. Robaa, C. Romier, R. J. Pierce, M. Jung, W. Sippl;
ChemMedChem. 13 (2018) 1517.
Link
Fluorescence-Based Screening Assays for the NAD+-Dependent Histone Deacetylase smSirt2 from Schistosoma mansoni.
M. Schiedel, M. Marek, J. Lancelot, B. Karaman, I. Almlöf, J. Schultz, W. Sippl, R. J. Pierce, C. Romier, M. Jung; J. Biomol. Screen. 20 (2015) 112-121. Link (open access)
-
Sirtuine
Acetyltransferasen (HATs)
- Cofactor Analogues as Active Site Probes in Lysine Acetyltransferases.
R. P. Simon, T. Rumpf, V. Linkuvienė, D. Matulis, A. Akhtar, M. Jung;
J. Med. Chem. 62 (2019) 2582-2597.
Link
Link to preprint at ChemRxiv (open access)
- pCAF
- p300
- MOF
Methyltransferasen
- New lysine methyltransferase drug targets in cancer.
T. Wagner, M. Jung; Nat. Biotechnol. 30 (2012) 622-623. (Review) Link
FAD-abhängige Histon-Demethylasen(lysinspezifische Demethylase LSD1)
- Structure-activity studies on N-substituted tranylcypromine derivatives lead to selective inhibitors of lysine specific demethylase 1 (LSD1) and potent inducers of leukemic cell differentiation.
J. Schulz-Fincke, M. Hau, J. Barth, D. Robaa, D. Willmann, A. Kürner, J. Haas, G. Greve, T. Haydn, S. Fulda, M. Lübbert, S. Lüdeke, T. Berg, W. Sippl, R. Schüle, M. Jung;
Eur. J. Med. Chem. 144 (2018) 52-67.
Link
Eisen-/α-ketoglutarat-abhängige Histon-Demethylasen (JumonjiC Domain-Containing Histone Demethylase JmjD2A)
- The Clinically Used Iron Chelator Deferasirox is an Inhibitor of Epigenetic JumonjiC Domain-Containing Histone Demethylases.
Roatsch, M., Hoffmann, I., Abboud, M. I., Hancock, R. L., Tarhonskaya, H., Hsu, K.-F.; Wilkins, S. E., Yeh, T.-. lan ., Lippl, K., Serrer, K., Moneke, I., Ahrens T. D.,
Robaa, D., Wenzler, S., Franz, H., Sippl, W., Lassmann, S., Diederichs, S., Schleicher, E., Schofield, C. J., Kawamura, A., Schüle, Jung, M.;
Chem Rxiv. preprint (2019) Link
- 4-Biphenylalanine- and 3-Phenyltyrosine-Derived Hydroxamic Acids as Inhibitors of the JumonjiC-Domain-Containing Histone Demethylase KDM4A.
L. Morera, M. Roatsch, M. C. D. Fürst, I. Hoffmann, J. Senger, M. Hau, H. Franz, R. Schüle, M. R. Heinrich, M. Jung;
ChemMedChem. 11 (2016) 2063-2083. Link
Methyllysin-Reader-Proteine
<
Beispiele aus der aktuellen Forschung
"Reader"-Proteine
Die Funktion eines "Reader"-Proteins ist hier dargestellt am Beispiel eines Proteins, das dreifach-methylierte Lysinreste (Kme3) erkennt (Abbildung links). 1
Kooperationspartner aus Freiburg konnten zeigen, dass ein solches Reader-Protein, das Spindlin 1 (Spin1), an der Entstehung bzw. der Progression einer bestimmten Krebsart (Liposarkom) beteiligt ist (Abbildung rechts).2
Es stellt also ein interessantes Target für die Wirkstoffforschung dar.
Durch Testung in verschiedenen biochemischen Assays konnten wir zeigen, dass die Bindung von Spin1 an Kme3 durch niedermolekulare Verbindungen konzentrationsabhängig blockiert werden kann.3
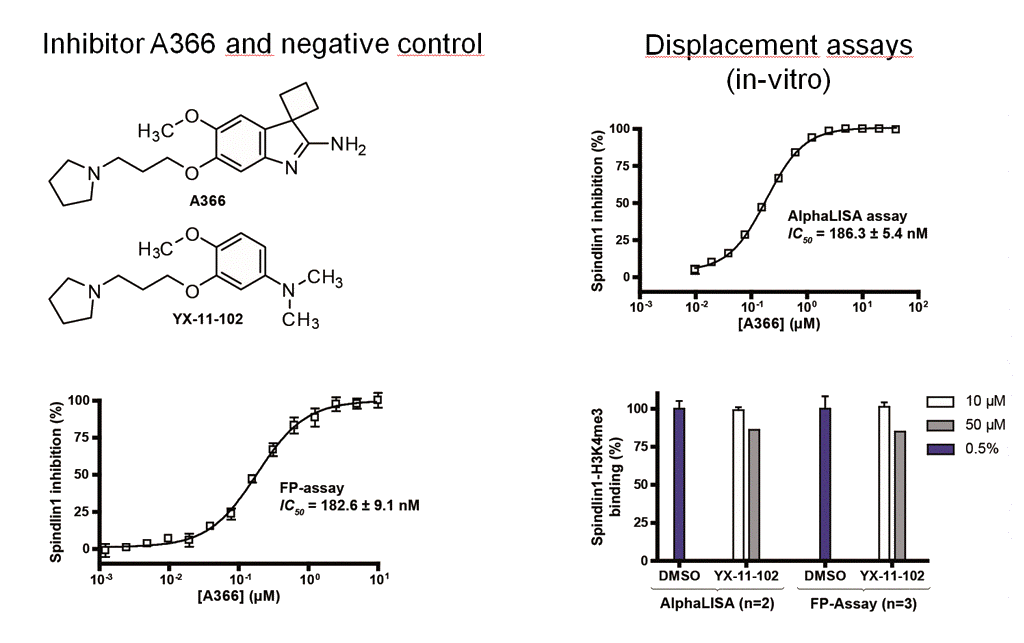
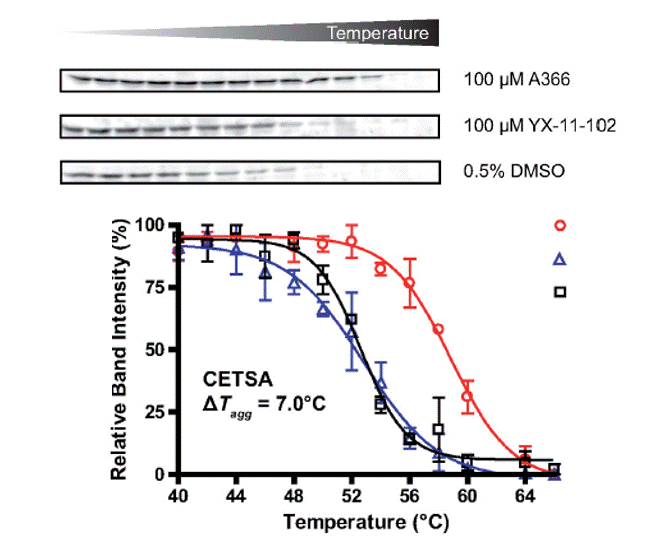
Mithilfe eines zellulären Bindunsgsassays (CETSA) waren wir als erste Arbeitsgruppe überhaupt in der Lage, die Bindung eines Hemmstoffs an einem Methyllysin-Reader-Protein (hier Spin1) auf zellulärer Ebene zu validieren.3
Hemmstoffe und PROTACs NAD+-abhängiger Histon-Desacetylasen (Sirtuine)
Die Sirtuine stellen eine spezielle Klasse der Histon-Desacetylasen dar, die neben Histonen auch zahlreiche andere Proteine desacylieren. Sie spielen bei diversen Krankheitsbildern wie Krebs, aber auch M. Alzheimer, M. Parkinson oder Diabetes mellitus eine Rolle.4 Für Arbeiten an Sirtuinen 5 erhielten wir 2016 den Phoenix Pharmazie
Wissenschaftspreis.
Vor einiger Zeit wurde die sogenannte PROTAC-Technik entwickelt. Hierbei werden Hybrid-Moleküle synthetisiert, bestehend aus einem Liganden für ein bestimmtes Zielprotein und einem Molekülteil, welcher Protein-Abbau initiiert. Dadurch können gezielt, je nach Auswahl des Liganden, bestimmte Zielproteine abgebaut werden.6
Uns ist es gelungen, dieses Konzept auf einen unserer potenten und selektiven Sirt2-Hemmstoffe (SirReal 2, Abbildung links) anzuwenden und damit einen selektiven Abbau von Sirtuin 2 in HL60-Zellen (Abbildung Mitte) und Sirt2-überexprimierenden HeLa-Zellen (Abbildung rechts) nachzuweisen.5 ,7
<
1 Mind the Methyl: Methyllysine Binding Proteins in Epigenetic Regulation. T. Wagner, D. Robaa, W. Sippl, M. Jung; ChemMedChem 9 . (2014) 466-483. (Review) Link
2 The histone code reader SPIN1 controls RET signaling in liposarcoma. H. Franz, H..Greschik, D Willmann, L. Ozretic, C. Jilg, E. Wardelmann, M. Jung, R. Buettner, R. Schüle; Oncotarget. 6 (2015) 4773-4789. Link (open access)
3 Identification of a small-molecule ligand of the epigenetic reader protein Spindlin1 via a versatile screening platform. T. Wagner, H. Greschik, T. Burgahn, K. Schmidtkunz, A.-K. Schott, J. McMillan, L. Baranauskiene, Y. Xiong, O. Fedorov, J. Jin, U. Oppermann, D. Matulis, R. Schüle, M. Jung;
Nucleic Acids Res. 44 (2016) e88. Link (open access)
4 The Current State of NAD+-Dependent Histone Deacetylases (Sirtuins) as Novel Therapeutic Targets. M. Schiedel, D. Robaa, T. Rumpf, W. Sippl, M. Jung;
Med. Res. Rev. 37 (2017) (Review) Link
5 Selective Sirt2 inhibition by ligand-induced rearrangement of the active site. T. Rumpf, M. Schiedel, B. Karaman, C. Roessler, B. J. North, A. Lehotzky, J. Oláh, K. I. Ladwein, K. Schmidtkunz, M. Gajer, M. Pannek, �C. Steegborn, D. A. Sinclair, S. Gerhardt, J. Ovádi, M. Schutkowski, W. Sippl, O. Einsle, M. Jung;
Nat. Commun. 6 (2015) 6263. Link (open access)
6 Phthalimide conjugation as a strategy for in vivo target protein degradation. G. Winter, D. Buckley, J. Paulk, J. Roberts, A. Souza, S. Dhe-Paganon, J. Bradner;
Science. 348 (2015), 1376-1381. Link (open access)
7 Aminothiazoles as Potent and Selective Sirt2 Inhibitors: A Structure-Activity Relationship Study. M. Schiedel, T. Rumpf, B. Karaman, A. Lehotzky, J. Oláh, S. Gerhardt, J. Ovádi, W. Sippl, O. Einsle, M. Jung;
J. Med. Chem. 59 (2016) 1599-1612. Link
|
|